美国食品药品监督管理局(FDA)已授予 emactuzumab 快速通道资格,用于治疗不适合手术或无法从手术中受益的腱鞘巨细胞瘤(TGCT)患者。
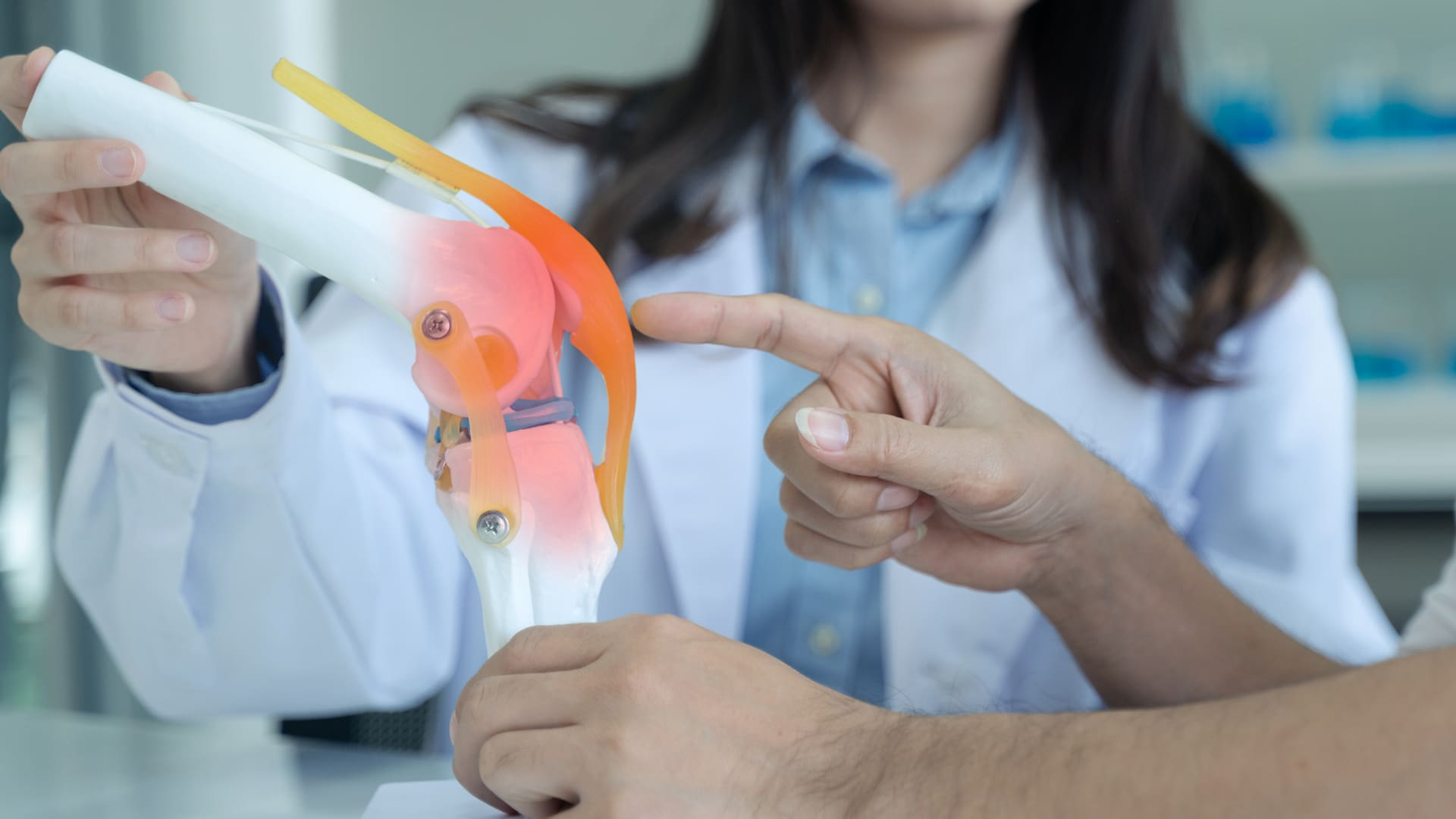
TGCT 是一种罕见的非恶性肿瘤,但生长迅速,主要发生在滑膜、腱鞘和滑囊膜上,主要发生在膝关节、髋关节和踝关节,由脑脊液-1(CSF-1)过量分泌引起。该疾病是一种慢性致残性疾病,会导致患者受累关节功能丧失,并伴有疼痛、僵硬和活动范围受限。TGCT 获得 FTD 认证是基于 1/2 期临床研究的数据,这些研究表明该药物可快速、有效地缩小肿瘤,疗效持久,且安全性可控。Emactuzumab 此前也已获得欧洲药品管理局的孤儿药项目认定。
关于腱鞘巨细胞瘤(TGCT)
腱鞘巨细胞瘤(TGCT),以前称为色素绒毛结节性滑膜炎(PVNS),是一种影响关节和肌腱软组织内层的肿瘤。根据世界卫生组织(WHO)的分类,TGCT 被归类为纤维组织细胞肿瘤,并根据生长模式(局限性和弥漫性)和位置(腱鞘、关节内和关节外型)进行细分。TGCT 具有局部破坏性,并且可能具有侵袭性。该疾病会导致严重的关节疼痛、僵硬、功能丧失和生活质量下降。虽然大多数患者都会接受手术,但超过 50% 的弥漫性 TGCT 患者会在三年内出现肿瘤复发。如果不及时治疗,TGCT 会导致关节畸形、退行性变,严重的情况下甚至需要关节融合术或截肢。
关于CSF-1和Emactuzumab
CSF-1(巨噬细胞集落刺激因子)是一种与CSF-1受体(CSF-1R)结合的细胞因子,该受体在巨噬细胞和其他免疫细胞上表达。Emactuzumab是一种靶向CSF-1R的人源化IgG1单克隆抗体,旨在抑制和清除肿瘤组织中的巨噬细胞。Emactuzumab最初由罗氏公司开发,在睾丸肿瘤细胞(TGCT)的临床研究中已显示出显著疗效,包括约71%的客观缓解率、快速的肿瘤缩小、功能改善、良好的耐受性和可控的安全性。Emactuzumab也可能用于治疗其他巨噬细胞驱动的疾病,SynOx正在积极探索这些领域的进一步开发机会。
有关正在进行的注册第 3 阶段 TANGENT 研究的更多详细信息,可在 ClinicalTrials.gov(标识符:NCT05417789)上找到。
SynOx Therapeutics 首席医疗官 Elyse Seltzer 医学博士表示:“emactuzumab 获批用于治疗 TGCT 患者,突显了该疾病对患者造成的毁灭性打击,以及对新型治疗方案的迫切需求。基于我们迄今为止的临床工作,我们相信 emactuzumab 具有巨大的潜力,能够满足关键的患者需求,它能够提供有效的短期治疗,快速起效,疗效持久,使 TGCT 患者能够更好地控制病情,继续生活。”
参考来源:‘SynOx Therapeutics receives Fast Track designation from US Food and Drug Administration for emactuzumab for tenosynovial giant cell tumours (TGCT). News release. SynOx Therapeutics. April 14, 2025.’
香港登越药业温馨提示:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。
(责任编辑:登越药房)





