Amlitelimab 是一款在研抗 OX40 配体单克隆抗体,旨在使特应性皮炎患者过度活跃的免疫反应恢复正常,且不会消耗 T 细胞。COAST 1 试验(ClinicalTrials.gov 标识符:NCT06130566)纳入了 12 岁及以
Amlitelimab 是一款在研抗 OX40 配体单克隆抗体,旨在使特应性皮炎患者过度活跃的免疫反应恢复正常,且不会消耗 T 细胞。COAST 1 试验(ClinicalTrials.gov 标识符:NCT06130566)纳入了 12 岁及以上患有中度至重度特应性皮炎的患者,这些患者的病情无法通过局部处方疗法得到充分控制,或不宜使用局部处方疗法。
研究参与者(N=601)被随机分配接受每4周(Q4W)或每12周(Q12W)皮下注射amlitelimab(250毫克,体重<40公斤时125毫克),并在接受负荷剂量(500毫克,体重<40公斤时250毫克)或安慰剂治疗后进行。在美国,主要终点是第24周时经验证的研究者整体评估量表(vIGA-AD)评分为0分(痊愈)或1分(几乎痊愈)且较基线至少下降2分的患者比例。
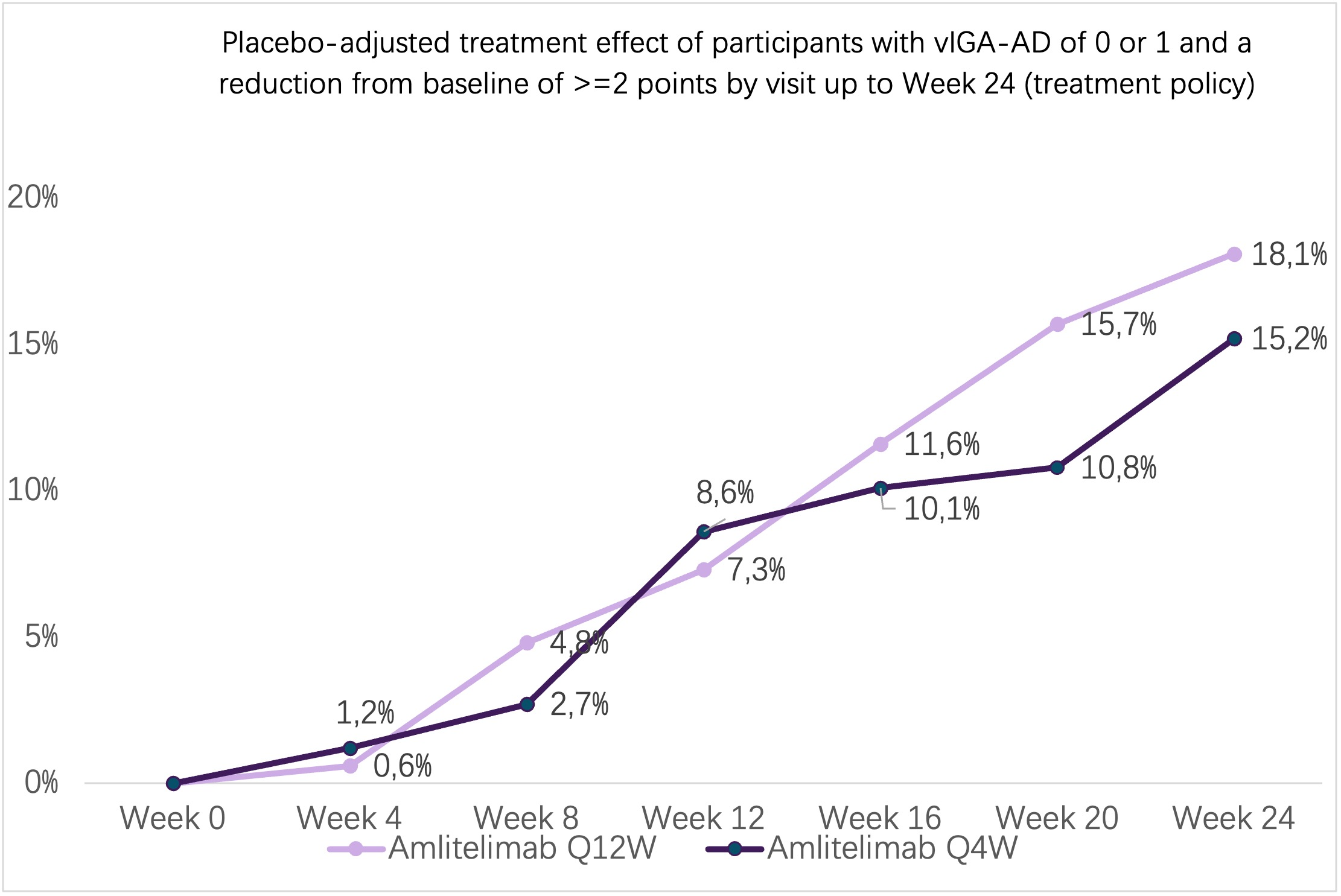
研究结果显示,两种剂量方案的amlitelimab均与皮损清除率和病情严重程度的显著改善相关,且具有统计学意义和临床意义。在amlitelimab Q4W组中,21.1% ( P <.01) 至 26.5% ( P <.001) 的患者(取决于患者纳入因素)达到vIGA-AD 0/1。同样,在amlitelimab Q12W组中,22.5% ( P <.01) 至 29.1% ( P <.001) 的患者达到vIGA-AD 0/1。在安慰剂组中,达到vIGA-AD 0/1的比例为9.2%至10.5%。关键次要终点也得到了显著改善。
赛诺菲执行副总裁兼研发主管Houman Ashrafian表示:“Amlitelimab的这些积极的III期临床试验结果进一步证实了其靶向OX40配体,在不消耗T细胞的情况下使过度活跃的免疫系统恢复正常的潜力。Amlitelimab可能代表特应性皮炎治疗领域的重大进展,其疗效具有临床意义且逐步提升,并且每年只需给药4次。”
该试验的更多数据将在未来的医学会议上公布。COAST 1 研究是赛诺菲 OCEANA 临床开发项目中五项 3 期试验之一,旨在评估 amlitelimab 治疗特应性皮炎的效果。
参考来源:Sanofi’s amlitelimab met all primary and key secondary endpoints in the COAST 1 phase 3 study in adults and adolescents with atopic dermatitis.
温馨提示:以上资讯由香港登越药业整理编辑(如有错漏,请帮忙指正),提供全球最新上市药品的资讯,具体用药指引,请咨询主治医师。
(责任编辑:登越药业)





