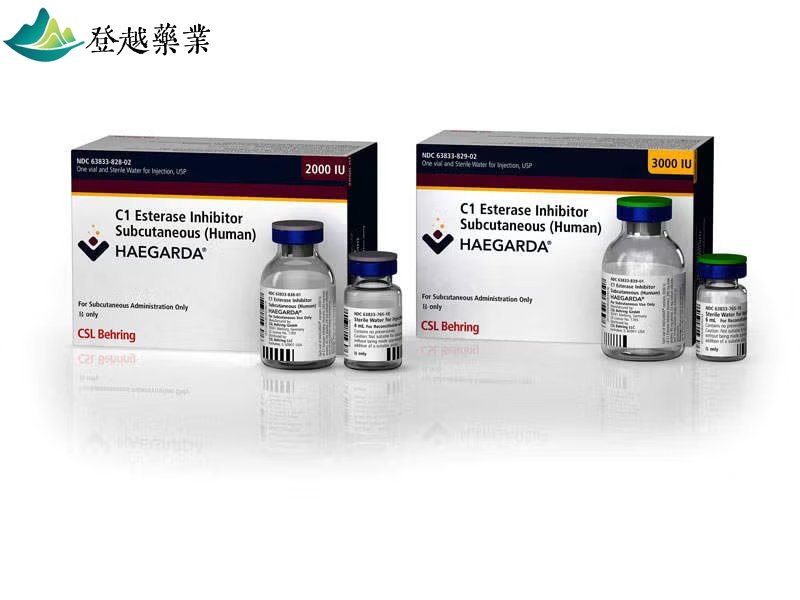
HAEGARDA ( Haegarda )是由 CSL Behring 公司开发的一款 C1酯酶抑制剂 (C1-INH),用于预防 遗传性血管性水肿 (HAE)发作。该药物于2025年6月获得 美国食品药品监督管理局 (FDA)批准上市,成为首款皮下注射型C1-INH类药物。
药物特性
HAEGARDA通过皮下注射给药,主要成分为人血浆中提取的C1酯酶抑制剂,经过纯化、巴氏消毒和冻干制备。其工作原理是通过补充患者体内缺乏的C1酯酶抑制剂蛋白,纠正补体系统紊乱,从而减少HAE发作。
临床试验数据
在多中心临床试验中,90名12-72岁HAE患者被随机分为两组:
每周两次接受40 IU/kg剂量治疗的患者,HAE发作率下降89%;
每周两次接受60 IU/kg剂量治疗的患者,发作率下降95%,其中40%的患者完全无发作。
适应症扩展
2025年1月,FDA批准HAEGARDA扩大适应症,用于6岁及以上患者的常规预防性治疗。此前,另一款药物 Takhzyro 已获FDA批准用于2-12岁儿童患者。
温馨提示:以上资讯由香港登越药业整理编辑(如有错漏,请帮忙指正),提供全球最新上市药品的资讯,具体用药指引,请咨询主治医师。