
土耳其卫生署正规授权
全球药品进出口批发商


全球药品进出口批发商

 FDA 已接受审查重新提交的 STS101 新药申请
FDA 已接受审查重新提交的 STS101 新药申请
新的 PDUFA 目标日期是 2025 年 4 月 30 日。...
查看详情 Rapiblyk 获 FDA 批准用于治疗室上性心动过速
Rapiblyk 获 FDA 批准用于治疗室上性心动过速
兰地洛尔是一种选择性β-1肾上腺素受体阻滞剂,作用持续时间非常短。...
查看详情 FDA 已授予 LBS-007 快速通道资格用于治疗 AML
FDA 已授予 LBS-007 快速通道资格用于治疗 AML
FDA 授予 LBS-007 快速通道资格,用于治疗急性髓细胞白血病 (AML) 患者。该药物的 1/2 期试验 (NCT05756322) 目前正在美国、...
查看详情 FDA收到RP1和Nivolumab联合治疗晚期黑色素瘤的BLA
FDA收到RP1和Nivolumab联合治疗晚期黑色素瘤的BLA
美国食品药品监督管理局 (FDA) 还授予该组合疗法在相同环境下的突破性治疗称号。...
查看详情 LBL-024 获得 FDA 神经内分泌癌孤儿药资格
LBL-024 获得 FDA 神经内分泌癌孤儿药资格
FDA 已授予 LBL-024 孤儿药资格(ODD),用于治疗神经内分泌癌。该药物已获得中国FDA和国家药品监督管理局(NMPA)的新...
查看详情 FDA接受Blenrep组合疗法的生物制品许可申请 (BLA)
FDA接受Blenrep组合疗法的生物制品许可申请 (BLA)
FDA 已接受了 belantamab mafodotin (Blenrep) 的生物制剂许可申请 (BLA),该药物联合硼替佐米 (Velcade) 和地塞米松 (BVd) 以及联...
查看详情 伊马替尼口服溶液已获FDA批准用于治疗某些癌症
伊马替尼口服溶液已获FDA批准用于治疗某些癌症
FDA 已批准伊马替尼口服溶液(Imkeldi)用于治疗某些形式的白血病和其他癌症。这是首个用于治疗特定癌症的伊马替尼...
查看详情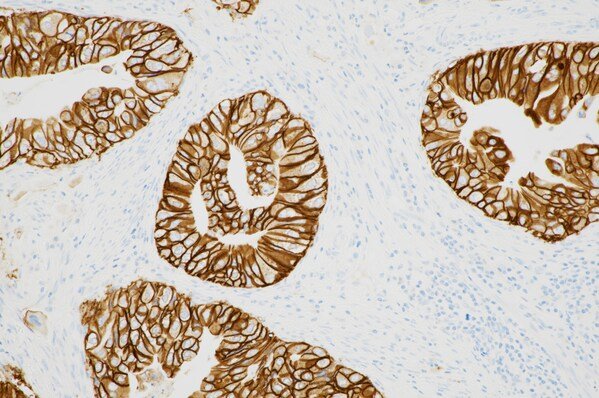 FDA扩大Pathway兔单克隆抗体在癌症胆道患者中应用
FDA扩大Pathway兔单克隆抗体在癌症胆道患者中应用
这是第一个也是唯一一个获得 FDA 批准的伴随诊断,用于辅助评估 HER2 阳性状态以确定适合使用 zanidatamab 的 BTC 患者。...
查看详情 BridgeBio 的 Attruby 获FDA批准用于治疗罕见心脏病
BridgeBio 的 Attruby 获FDA批准用于治疗罕见心脏病
早在第 28 天就观察到体外 TTR 接近完全稳定,并且在对 ATTR-CM 患者进行 30 个月的研究后也取得了进展。...
查看详情 Miplyffa 现已上市用于治疗 C 型尼曼匹克病
Miplyffa 现已上市用于治疗 C 型尼曼匹克病
Miplyffa™(arimoclomol)现可与miglustat联合使用,治疗成人和 2 岁及以上的儿科患者的 C 型尼曼匹克病 (NPC) 神经系统表现...
查看详情